企業治験でモニタリング担当をしている人でも知らない、医師主導治験独特の2つのルールがあります。
これらを知らずして、医師主導治験のモニタリングを企業治験経験者に依頼してしまうと、イタイ思いをすることになるため、必ず理解しておきたい事項です。
- モニターの役割
- モニタリング報告書は、IRBに審議されるもの
今回は上記の2つの違いを踏まえて、医師主導治験におけるモニタリング担当者の役割とモニタリング報告書について、詳しくご紹介していきます。
医師主導治験と企業治験の違いについては「「医師主導治験」と「企業治験」の違い 6つのポイントを抑える」に詳しく記載しています。
治験に関する参考図書を準備しておくとよりスムーズです。
医師主導治験と企業治験におけるモニタリング担当者の役割の違い
医師主導治験におけるモニタリング担当者の役割として、企業治験と大きく違うことは、第三者的に関わるということが挙げられます。
治験実施上の疑問点は、自ら解決していく為、実施医療機関からの質問や回答についても、基本的には自ら治験を実施する者が行うという考えからです。
例えば、施設間の調整を治験責任医師から依頼されたとします。
この場合は、治験事務局に相談し、調整してもらいましょう。
モニタリング担当者は、あくまで、担当する治験の品質管理業務に徹底することが望ましいです。
医師主導治験と企業治験のモニタリング業務に関する違い
そこでまず初めに、医師主導治験と企業治験のモニタリング担当者の役割について、差異のある箇所のみ抜粋しましたのでご覧ください。
| 違いのある項目 | 医師主導治験 | 企業治験 |
|---|---|---|
| モニタリング報告書の提出先 | 実施医療機関の長 or 自ら治験を実施する者 | 治験依頼者 |
| モニタリング報告書の提出後 | IRBで審議 | QCチェック後、社内で保管 |
| 施設・医師等との情報共有 | 治験調整事務局協力の元、 自ら治験を実施する者が担当 | モニターが担当 |
| 被験者登録情報の確認 | 治験調整事務局が担当 | モニターが担当し治験依頼者へ報告 |
医師主導治験におけるモニタリング報告書の提出先
医師主導治験では、モニタリング報告書の提出先は実施医療機関の長または、自ら治験を実施する者です。
実施医療機関の長に提出するか、自ら治験を実施する者に提出するかの違いは、以下で判断できます。
- 単施設か多施設か
- モニタリング報告書の内容が自ら治験を実施する者がいる施設か、いない施設か
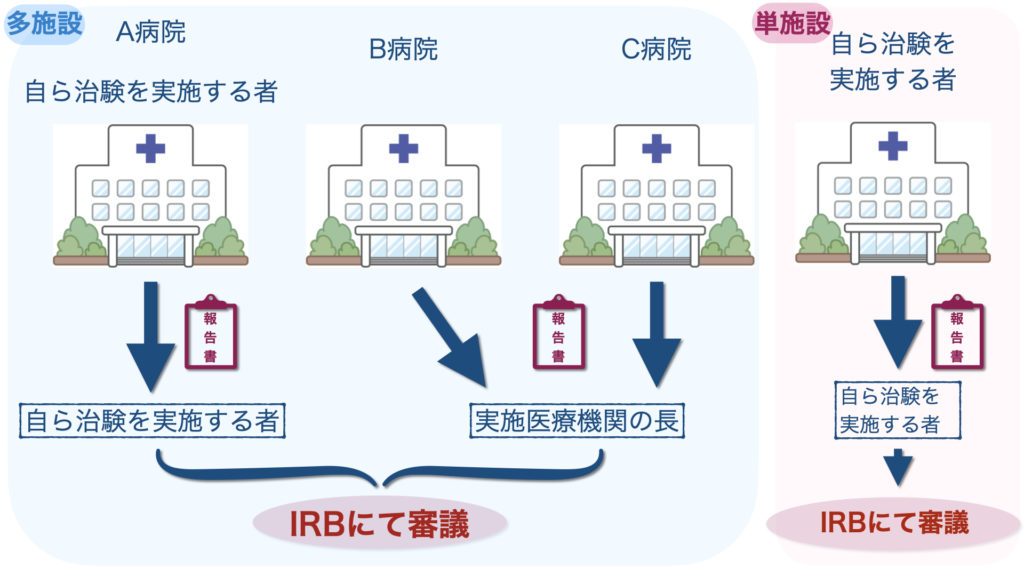
例えば、1人のモニターが3施設(自ら治験を実施する者がいるA病院、B病院、C病院)のモニタリングを担当するとします。
A病院では、自ら治験を実施する者へモニタリング報告書を提出します。
残りのB病院、C病院では、実施医療機関の長にモニタリング報告書を提出します。
単施設の場合は、モニタリング報告書の提出先は必然的に、自ら治験を実施する者になりますね。
- 企業治験においては、社内でQCチェックをかけた後、社内の治験必須文書として保管
- 医師主導治験においては、自ら治験を実施する者または、医療機関の長に提出後、IRBにて審議
医師主導治験において、モニタリング報告書は、IRBにて審議される為、書き方の工夫も必要になりますね。
医師主導治験におけるモニタリング担当者の情報交換への関わり方

企業治験において、各病院間や治験責任医師等の連絡調整等については、モニターが行います。
しかし、医師主導治験では、治験調整事務局協力の元、自ら治験を実施する者が担当します。
理由は、冒頭でも述べましたが、治験実施上の疑問点は、基本的には自ら治験を実施する者が行うという考えからです。
実情としては、自ら治験を実施する者が治験調整事務局に連絡し、治験調整事務局担当者が多施設にコンタクトを取るという流れになることが多いです。
医師主導治験における施設間・医師等への連絡調整については、自ら治験を実施する者が担当するため、モニターは関与しません。
繰り返しますが、モニタリング担当者はあくまで、治験の品質管理活動が主な役割になります。
医師主導治験と企業治験では、モニターの役割が違いますので、しっかり覚えておきましょう。
医師主導治験においてモニタリング担当者選定で注意すべきこと
医師主導治験において、誰でもモニタリング担当者になれるわけではありません。
モニターはモニタリングの対象となる実施医療機関においてその対象となる治験に従事してはならない。
例えば、自院でモニタリング部門を設けている場合が該当します。
医師主導治験におけるモニタリングとは、第三者的な立場で当該治験に関わるため、その治験に治験事務局や治験協力者などの立場で関わることができません。
該当者が不在な場合は、外部のモニタリング委託をすることになります。
医師主導治験におけるモニタリング報告書作成のポイント
医師主導治験において、モニタリング報告書の書き方は、簡潔明瞭に記載する必要があります。
理由は、モニタリング報告書の提出先が治験審査委員会(以後、IRB)だからです。
IRB委員は、必ずしも全員が医療に熟知しているわけではありません。
また、限られた時間内での審議を行うため、長い文章より、短文で問題点と解決法わかるようにすることがポイントです。
例えば、以下のように書き換えておきましょう。
WBCが大幅に低下したため、治療を中断した。
↓↓
白血球が大幅に低下したため、治療を中断した。
SDVのため、治験事務局経由で施設利用のアポイントを取った。
↓↓
削除(不要です)
また、一事象、一行くらいで箇条書きに起承結が書かれていると、読み手は理解しやすいです。
先にも述べましたが、医師主導治験では、モニタリング報告書はIRBでの審議書類になります。
そのため、治療上の専門用語など、わかりにくい言葉は使わないようにしましょう。
まとめ
今回は、医師主導治験における、モニタリング担当者の役割と、モニタリング報告書作成のポイントについて解説しました。
医師主導治験におけるモニタリング担当者の役割は、第三者としての監査的な役割があり、施設間の調整等の内部業務には関与しません。
また、作成したモニタリング報告書は、IRBで審議されるため、書き方も注意していく必要があります。
以上について、知っていると医師主導治験のモニタリング業務をスムーズに全うすることができますね。
医師主導治験の流れや注意点については、「医師主導治験の流れ・注意点をわかりやすく解説」の記事に詳しく書いています。
 医師主導治験の総括
医師主導治験の総括