医師主導治験を始めるなら、手際良く、抜けの無いように準備を始めたいですよね。
医師主導治験の全体像については理解できるものの、企業治験との違いや注意点等に至るまでの情報がなかなか得られない状況です。
そこで今回は、企業治験との違いやイベント毎の注意点などを含めた医師主導治験の流れをご紹介していきます。
前倒しで準備を始め、余裕を持って対応することができるようになります。
治験に関する参考図書を準備しておくとよりスムーズです。
医師主導治験の全体像と流れ
医師主導治験の流れがわかるように全体像をご紹介します。
下の図をご覧ください。
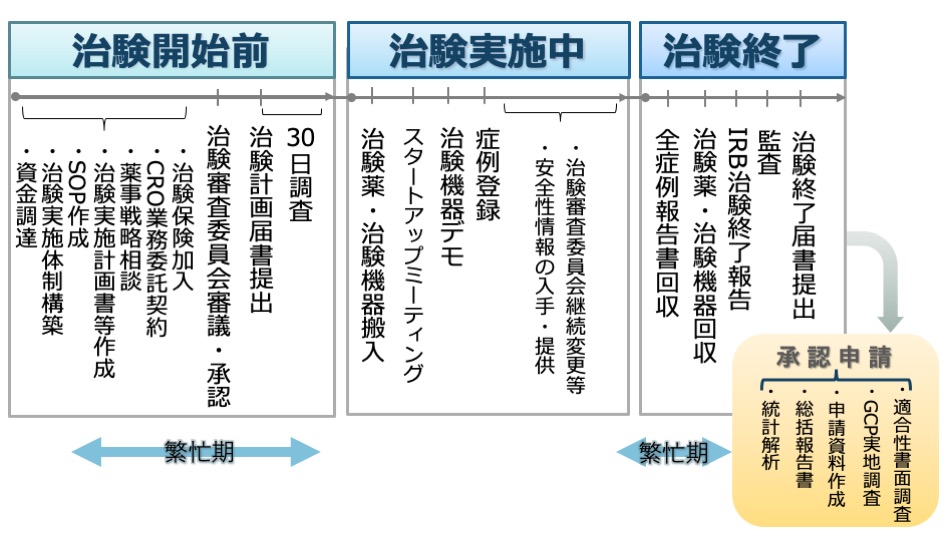
治験薬や治験機器の治験計画が立てられ、それらが承認に至るまで、大きく4つの段階に分けられます。
- 治験開始前
- 治験実施中
- 治験終了後
- 承認申請準備
※こちらでは、治験開始前に実施する非臨床試験等については省いています。
治験の流れとして、医師主導治験と企業治験との違いについては、「「医師主導治験」と「企業治験」の違い 6つのポイントを抑える」をご覧ください。
治験準備段階のイベントと注意点
資金調達をした後は、治験の準備段階において、最も忙しい時期と言われています。
理由は、意思決定していくべき重要なイベントがいくつも同時進行されるためです。
具体的には、以下のイメージ図をご覧ください。
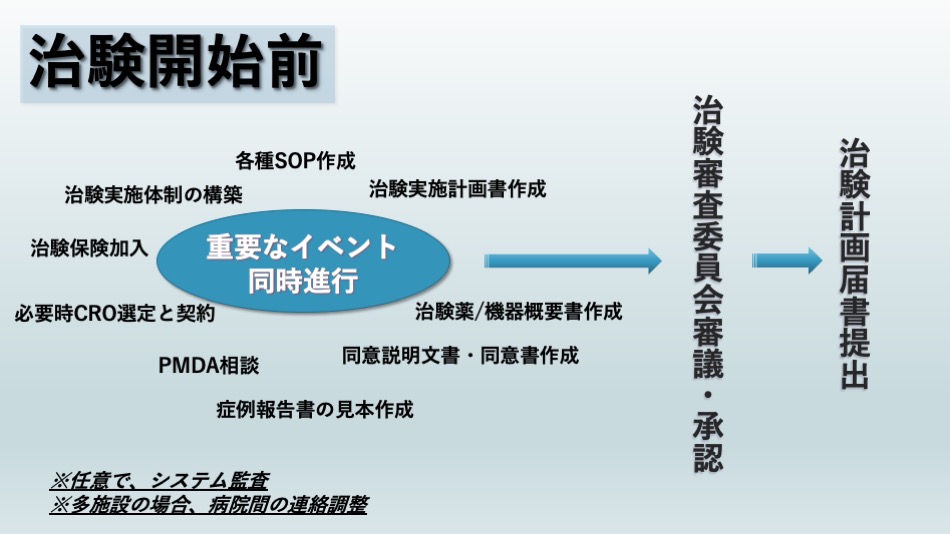
以下の6つが並行して準備していく必要があることがわかりますね。
- 治験実施体制の構築
- 各種SOP作成
- 治験実施計画書、治験薬/機器概要書、同意説明文書・同意書、症例報告書の見本を作成
- PMDA相談
- 必要時CROと契約
- 治験保険加入
また、通常は、治験審査委員会での審議・承認の前後でシステム監査をすることが多いです。
医療機関および治験の組織とその体制、システムの適切性を評価する監査のこと。
以下が主な対象で、治験準備段階では、1〜11が対象になります。
- 組織と機能
- 各責務の明確な割当て
- 必要なスタッフの配置と時間の確保
- SOPの整備と遵守状況
- 教育研修
- 治験実施計画書・説明同意文書の品質確保のプロセス
- データの品質管理プロセス
- 治験審査委員会の体制
- 検査室のプロセスや関連検査機材の品質管理
- 関係者間の情報伝達とコミュニケーション状況
- 原資料・治験記録類の管理等
- 治験薬や治験機器の管理
- 安全性情報の報告と管理
それでは、治験準備段階のイベントとその際の注意点についてそれぞれ解説していきます。
医師主導治験の資金調達と注意点
医師主導治験における最初の難関は、資金調達にあると言っても過言ではありません。
理由は、アカデミア価格が提供され、企業治験と比較してコストが抑えられているものの、やはり治験運営のため補助金や企業からの資金提供などがなければ、治験の継続は困難だからです。
資金調達をする際の注意点については、「医師主導治験の費用:補助金や企業からの資金提供を受ける際の注意点」に詳しく書いています。
医師主導治験の治験実施体制構築と注意点
治験実施体制構築における注意点としては大きく3つあります。
- 治験ごとに治験実施体制に若干の違いがある
- 薬事相談を利用する
- CROをどのように絡めていくか決める
一般的には、治験の要否は、PMDAの臨床試験要否相談で決まります。
そのため、PMDAに相談をする段階で、CROが絡んでいる場合があり、多くの場合はそのCROに医師主導治験の業務の一部を依頼しています。
理由は、今までの経緯を知っているため、治験を実施する際にスムーズに取り組んでもらえるからです。
CRO選定にも注意点があるため、これから実施する治験を十分に稼働させる能力のあるCROであるか見極めることが大切です。
本サイトでは、CRO選定におけるご相談を承っております。
医師主導治験の実施に必要なSOP雛形・作り方・注意点

医師主導治験ではまず下記の手順書を準備する必要があります。
企業治験で必要とするSOPの作成を依頼する場合は、こちらよりご連絡ください。
多施設共同治験においては、一般的に、治験全体で統一されたSOPが作成されます。
以下は、医師主導治験で必要とするSOP一覧になります。
- 医師主導治験における治験標準業務手順書
- 治験実施計画書及び症例報告書の見本の作成に関する手順書
- 治験薬/治験機器概要書の作成に関する手順書
- 説明文書及び同意文書の作成に関する手順書
- 被験者の健康被害補償方策に関する手順書
- 治験薬/治験機器の管理に関する手順書
- モニタリングの実施に関する手順書
- 安全性情報の取扱いに関する手順書
- 監査に関する計画書及び業務に関する手順書
- 多施設共同治験において治験調整医師又は治験調整委員会への業務の委嘱の手順書
- 効果安全性評価委員会(独立データモニタリング委員会)審議に関する手順書
- 記録の保存に関する手順書
- 総括報告書作成に関する手順書
- その他治験が適正かつ円滑に行われることを確保するために必要とされる手順書
上記のうちでも、モニタリングの実施に関する手順書と監査に関する手順書は、IRBで審議を必要とする書類のため、覚えておきましょう。
それ以外の手順書については、準備してある点のみ強調しておけば、IRB審議にかける必要はありません。
理由は、手順書改訂のたびに、IRB審議を要してしまうからです。
また、モニタリング・監査・データマネジメントなどについては、手順書を元に治験ごとに規定を細かく定めた、実施計画書も必要になります。
手順書・実施計画書・チェックリスト等はセットにして事前作成しておきましょう。
医師主導治験の治験実施計画書作成時のポイントと注意点
治験実施計画書を作成する際の指針は、医薬品と医療機器では異なるため注意が必要です。
- 医薬品 ICH-E6
- 医療機器 ISO14155:2020
ISO 14155:2020 は、ISOによって定められた、医療機器の臨床試験の実施の基準です。
被験者保護や臨床試験の科学的な質及び成績の信頼性を確保するために遵守するべき事項を定めています。
治験実施計画書作成におけるポイントは、作成した治験実施計画書の内容を全ての自ら治験を実施する者が合意しているということです。
理由は、実施医療機関の長に提出する書類であり、IRBにて審議・承認してもらうことが必須だからです。
そのためには、合意書を作成したり、保管用治験実施計画書そのものに、署名をもらっておくと良いでしょう。
また、プロトコル委員会や効果安全性評価委員会にあらかじめ審議を依頼し、治験に関与しない第三者の意見を聞いても良いです。
作成の経緯について第三者が理解できるような記録を残しておくことが望ましいです。
同意説明文書・同意書の作り方と注意点
同意説明文書・同意書は、今までの治験で使っていたものをテンプレートとして用いていくので構いません。
ただし、医師主導治験と企業治験の同意説明文書は、以下の点で違いがあるため、注意が必要です。
補償の内容
また、被験者は、上手な文章を読むより、図や表を用いた解説の方が理解しやすいです。
誰が読むかを意識した同意説明文書を作成するよう心がけましょう。
テンプレートをお持ちでなく、作成する時間もないと言う方は、以下よりお問い合わせください。
治験保険加入の注意点
治験保険加入にあたっては、気をつけたいことが2点あります。
- 医師主導治験と企業治験では補償範囲に違いがある
- 同意説明文書などの内容に影響する
治験保険は、医師主導治験と企業治験では補償範囲に違いがあります。
詳しくは、「医師主導治験で事前に知るべき治験保険の知識と被験者補償のための確認事項」に詳しく書いています。
これに関連して、同意説明文書内の記載に影響するため、注意が必要です。
治験保険を使うような場面には遭遇したくないですが、いざと言う時のために、保険の補償範囲等、担当者としっかりすり合わせして、メンバーに周知しておきましょう。
まとめ
今回は、医師主導治験の流れと注意点について解説しました。
 医師主導治験の総括
医師主導治験の総括 

